1.76除以44目录

假设1.76是被除数,44是除数。
根据除法的定义,我们可以建立以下方程:
结果=被除数÷除数
所以,结果=1.76÷44
现在我们要来解这个方程,找出结果的值。
计算结果为:0.04
所以,1.76除以44的结果是:0.04。收到你的喜欢啦收到你的喜欢啦

亲,你看哈,浓硫酸吸收水分,对CO2,CO没反应,那既然浓硫酸增重就是水的作用啦,所以,1.35就是水的质量了,那nH2O=1.35/18=0·075mol了。
剩下的气体就只有CO2和CO了,而碱石灰吸收CO2,对CO没作用,所以碱石灰增重的就是CO2作用了,那nCO2=1.76/44=0.04mol了。
剩下的CO燃烧后生成CO2,这里的nCO2=0.88/44=0.02mol了,因为在这里CO2和CO的质量守恒定律嘛,所以,CO的物质量就是0.02mol了。
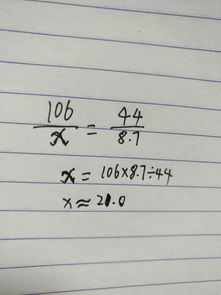
"生成co2质量1.763.254.4m"这句话是不是抄错了?我想应该是"生成co2质量1.76g3.52g4.4gm
如果这样的话
解:
(1).第三次和第四次有剩余
(2).既然第三次和第四次有剩余而稀盐酸质量一样所以m=4.4g
(3).设5克的石灰石中含碳酸钙n克
CaCO3 2HCl=H2O Co2(向上的箭头) CaCl2
100........................44
n.........................1.76g
n=4
4除以5=80
答:----------------------------
"......"表示空白

8014.6
用下标太麻烦了,我就没用下标了哈。
CaCO3 2HCl=CaCl2 H2O CO2
1007344
在第一问中,很明显,甲的石灰石中样品中的碳酸钙已经反应完全,但是盐酸仍有剩余,所以,设碳酸钙质量为X,X/100=1.76/44,计算得出X=4g,因此,碳酸钙的质量分数为80
第二问中,求盐酸的质量分数,则必须根据产生的CO2的质量来求取。
设盐酸质量为Y,Y/73=4.4/44,计算得出,Y=7.3g,因此,盐酸中溶质的质量分数是14.6。
