已知kahac=1.76目录
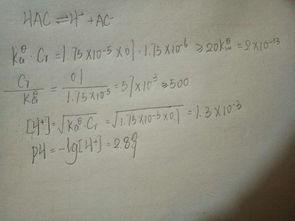
{H }=cKaHAc=0.1X1.76x10^-5开平方=1.33X10^-3mol/L
PH=-lg[H ]=-lg1.33X10^-3=2.88
PH=-㏒[H]碱Cb=0.1
[H]=√Ka×Ca得Ca=5.7混合后:
PH=PKa ㏒[Ac]\[HAc][Ac]=Cb×V\2V=0.05[HAc]=0.5×Ca-[Ac]=2.8所以PH=4.513望采纳,。
设平衡时[H ]=χ,HAc=H- Ac
起始相对浓度:0.1 0 0.1
平衡相对浓度:0.1-χχ 0.1 χ
Ka=(0.1 x)x/(0.1-x)=1.76*10-5
因为0.1/Ka>400,加上使平衡向左移动,所以0.1 χ≈0.1;0.1-χ≈0.1,
代入上式得:Ka=0.1x/0.1=x
即:[H] =1.76*10-5mol/L
解离度=1.76*10-5/0.1×100%=0.0176
同离子效应使HAc的解离度大幅下降
